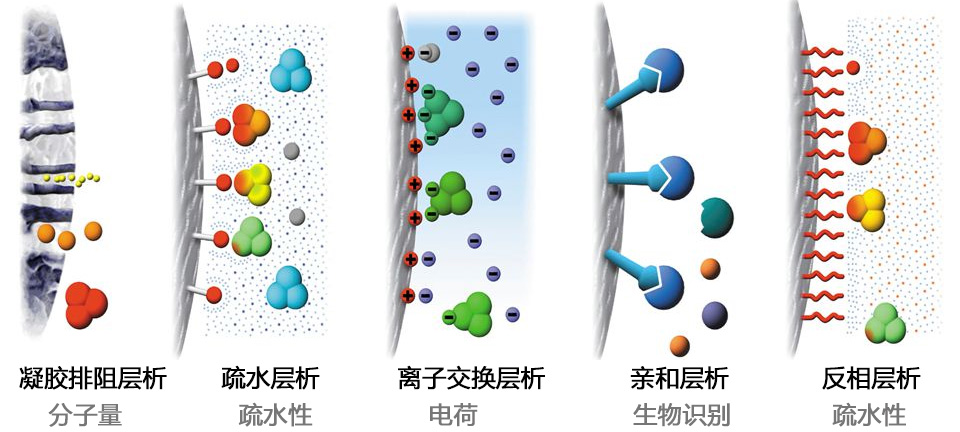
重組蛋白純化主要方法有三種:
親和層析:在生物分子中有些分子的特定結(jié)構(gòu)部位能夠同其他分子相互識別并結(jié)合�����,這種結(jié)合既是特異的��,又是可逆的����, 親和層析就是根據(jù)這樣的原理設(shè)計的蛋白質(zhì)分離純化方法。利用不同的層析柱����,采用親和層析的原理,對帶有His�,GST 或者M(jìn)BP標(biāo)簽的蛋白進(jìn)行純化,提高了純化效率����,增加蛋白純度,簡化操作步驟��,是重組蛋白首選的純化方法。
離子交換層析:由于蛋白質(zhì)也有等電點���,當(dāng)?shù)鞍踪|(zhì)處于不同的pH條件下�,其帶電狀況也不同��。陰離子交換基質(zhì)結(jié)合帶有負(fù)電荷的蛋白質(zhì)���,所以這類蛋白質(zhì)被留在柱子上�,然后通過提高洗脫液中的鹽濃度等措施����,將吸附在柱子上的蛋白質(zhì)洗脫下來。結(jié)合較弱的蛋白質(zhì)首先被洗脫下來����。常用的離子交換介質(zhì)有DEAE葡聚糖凝膠 A-25和 SP-瓊脂糖凝膠 HP(GE填料)。
凝膠排阻層析:凝膠層析是按照蛋白質(zhì)分子量大小進(jìn)行分離的技術(shù)����,又稱之凝膠過濾,分子篩層析或排阻層析�����。它的突出優(yōu)點是層析所用的凝膠屬于惰性載體 ,不帶電荷�,吸附力弱,操作條件比較溫和�����,可在相當(dāng)廣的溫度范圍下進(jìn)行���,不需要有機(jī)溶劑�����,并且對分離成分理化性質(zhì)的保持有獨到之處。
(資料來源:百度百科��、豆丁網(wǎng)b54vgpwe)

 武漢-光谷創(chuàng)贏
武漢-光谷創(chuàng)贏 天津-卡梅德生物
天津-卡梅德生物 南京-金斯瑞
南京-金斯瑞 上海-美迪西生物
上海-美迪西生物 北京-博奧森生物
北京-博奧森生物 杭州-晶佰生物
杭州-晶佰生物 北京-英茂盛業(yè)生物
北京-英茂盛業(yè)生物 北京-艾柏森生物
北京-艾柏森生物 合肥-知恩生物
合肥-知恩生物 成都-盛世君聯(lián)
成都-盛世君聯(lián)